Revisjonsspor: Sikrer sporbarhet og samsvar
I mange bransjer, spesielt i større organisasjoner, er det å opprettholde en uforanderlig revisjonsspor av alle databaseendringer ikke bare en beste praksis, men et lovkrav. Forskrifter som US FDA Title 21 CFR Part 11 krever streng journalføring og revisjonsspor for selskaper i medisinsk og farmasøytisk sektor. Men selv uten slike juridiske forpliktelser velger mange selskaper å implementere revisjonsspor for forbedret sporbarhet, ansvarlighet og dataintegritet.
PartsBox sin uforanderlige revisjonsspor
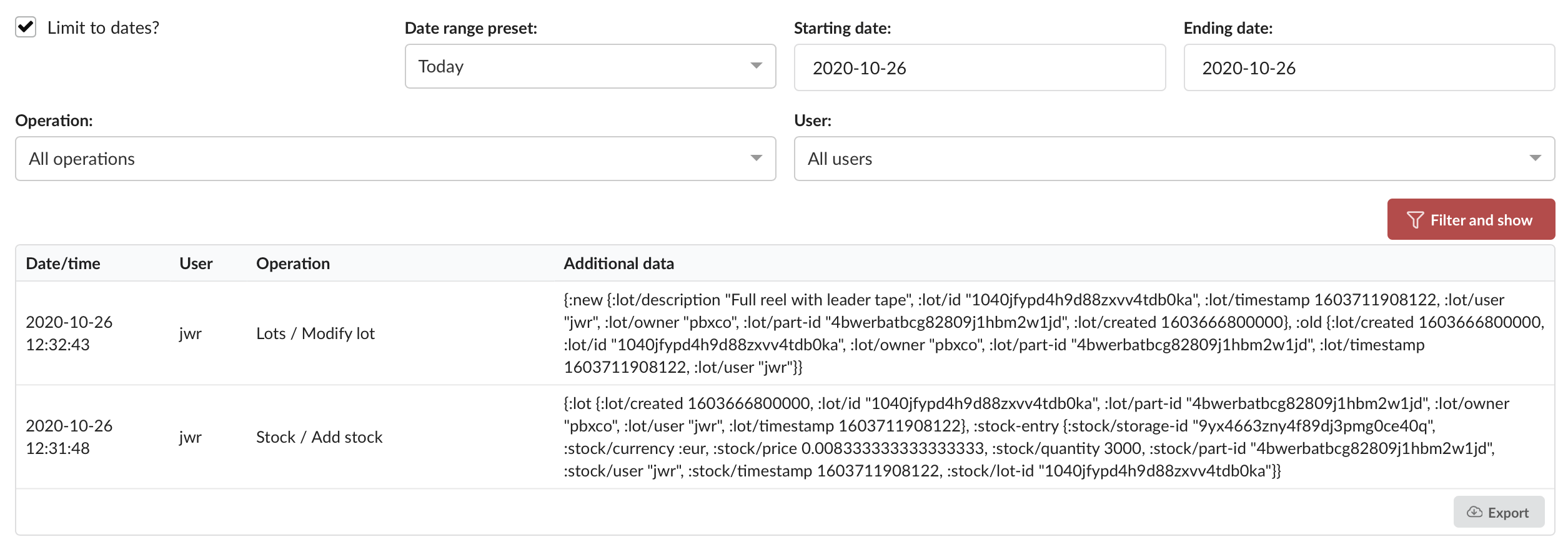
PartsBox tilbyr en robust, uforanderlig revisjonsspor-funksjon som automatisk registrerer en detaljert historikk over hver endring som gjøres i databasen. Hver revisjonsspor-oppføring inkluderer:
- Tidsstempel: Den nøyaktige datoen og klokkeslettet da endringen skjedde.
- Bruker: Brukerkontoen som utførte operasjonen, noe som muliggjør individuell ansvarlighet.
- Operasjon: Den spesifikke handlingen som ble utført, for eksempel oppretting, oppdatering eller sletting av en post.
- Posttype: Typen post som ble påvirket, for eksempel en komponent, lagerlokasjon, prosjekt eller bestilling.
- Post-ID: Den unike identifikatoren til den berørte posten.
- Endringer: Detaljert informasjon om hva som nøyaktig ble endret, inkludert gamle og nye verdier.
Denne omfattende revisjonssporingen sikrer at ingen endringer går upåaktet hen, og at det alltid er en klar, trinnvis historikk over hvordan databasen har utviklet seg over tid.
Eksport og signatur for regulatorisk samsvar
For å lette overholdelse av regelverk og strømlinjeforme revisjoner, lar PartsBox revisjonsspordata enkelt eksporteres i et standardisert format. Disse eksporterte dataene kan deretter signeres digitalt ved hjelp av sikre kryptografiske metoder, noe som gir et ekstra lag med integritet og autentisitet.
Kombinasjonen av en uforanderlig revisjonsspor og signerte eksporter gjør PartsBox godt egnet for bruk i regulerte bransjer. Det gir de nødvendige verktøyene for å oppfylle strenge krav til journalføring og demonstrere samsvar overfor revisorer og reguleringsorganer.
Tilgjengelighet og prising
Revisjonssporingsfunksjonen er inkludert i PartsBox sin Medical/Pharma-plan, som er skreddersydd for behovene til selskaper i medisinsk og farmasøytisk industri. For organisasjoner i andre sektorer som krever revisjonssporingsfunksjonalitet, er den tilgjengelig på forespørsel. Ta kontakt med vårt salgsteam for å diskutere dine spesifikke krav og priser.
Med PartsBox sitt revisjonsspor kan du ha tillit til integriteten og sporbarheten til dine lagerdata. Enten det er for regulatorisk samsvar eller bare for bedre datastyring, gir denne funksjonen et essensielt verktøy for å administrere elektroniske deler i dagens komplekse og krevende forretningsmiljø.