監査証跡:トレーサビリティとコンプライアンスの確保
多くの業界、特に大規模な組織では、すべてのデータベース変更の不変の監査証跡を維持することは、単なるベストプラクティスではなく、法的要件です。米国FDAタイトル21 CFR Part 11などの規制は、医療および製薬部門の企業に対して厳格な記録保持と監査証跡を義務付けています。しかし、そのような法的義務がなくても、多くの企業はトレーサビリティ、説明責任、およびデータの整合性を強化するために監査証跡を実装することを選択しています。
PartsBoxの不変監査証跡
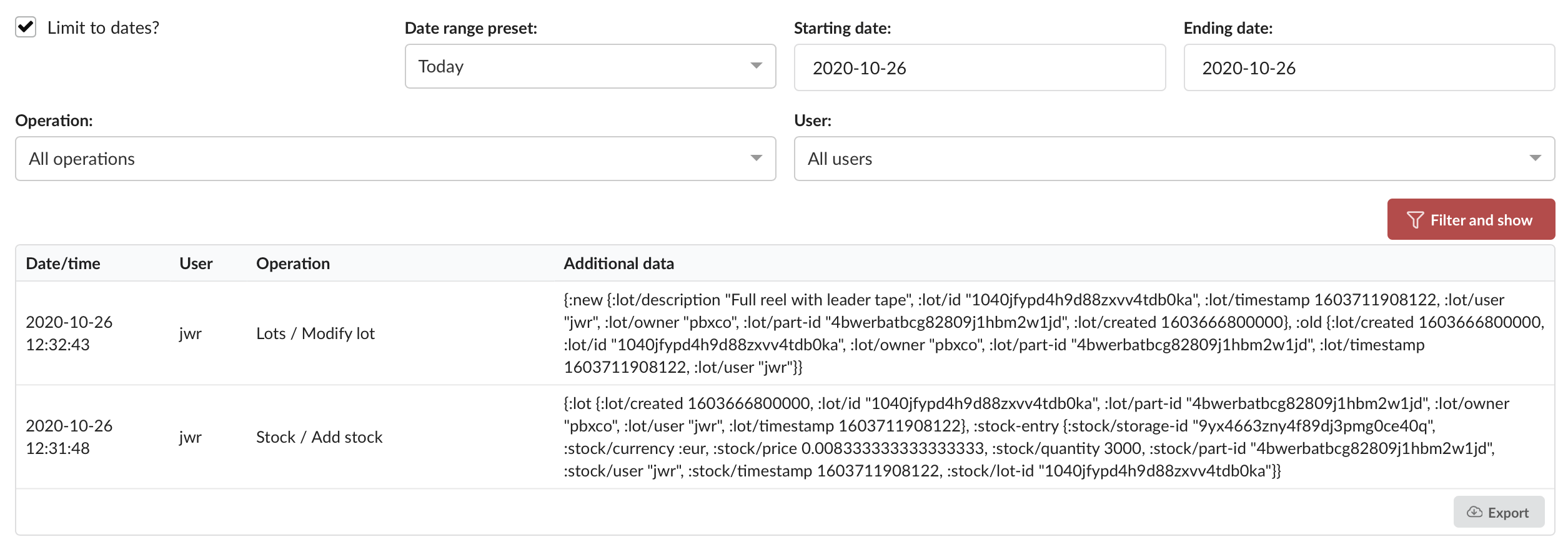
PartsBoxは、データベースに加えられたすべての変更の詳細な履歴を自動的に記録する、堅牢で不変の監査証跡機能を提供します。各監査証跡レコードには以下が含まれます:
- タイムスタンプ: 変更が発生した正確な日時。
- ユーザー: 操作を実行したユーザーアカウント。個人の説明責任を可能にします。
- 操作: レコードの作成、更新、削除など、実行された特定のアクション。
- レコードタイプ: 部品、保管場所、プロジェクト、注文など、影響を受けたレコードのタイプ。
- レコードID: 影響を受けたレコードの一意の識別子。
- 変更内容: 古い値と新しい値を含む、正確に変更された内容の詳細情報。
この包括的な監査証跡により、変更が見過ごされることはなく、データベースが時間の経過とともにどのように進化したかを示す明確で段階的な履歴が常に存在することが保証されます。
規制遵守のためのエクスポートと署名
規制遵守を促進し、監査を合理化するために、PartsBoxでは監査証跡データを標準化された形式で簡単にエクスポートできます。このエクスポートされたデータは、安全な暗号化方式を使用してデジタル署名することができ、整合性と真正性の追加レイヤーを提供します。
変更不可能な監査証跡と署名付きエクスポートの組み合わせにより、PartsBoxは規制産業での使用に最適です。厳格な記録保持要件を満たし、監査人や規制機関へのコンプライアンスを証明するために必要なツールを提供します。
在庫状況と価格
監査証跡機能は、医療および製薬業界の企業のニーズに合わせて調整されたPartsBoxのMedical/Pharmaプランに含まれています。監査証跡機能を必要とする他のセクターの組織の場合は、リクエストに応じて利用可能です。特定の要件と価格については、営業チームにお問い合わせください。
PartsBoxの監査証跡を使用すると、部品在庫データの整合性とトレーサビリティに自信を持つことができます。規制順守のためであれ、単により良いデータガバナンスのためであれ、この機能は今日の複雑で要求の厳しいビジネス環境において電子部品を管理するための不可欠なツールを提供します。